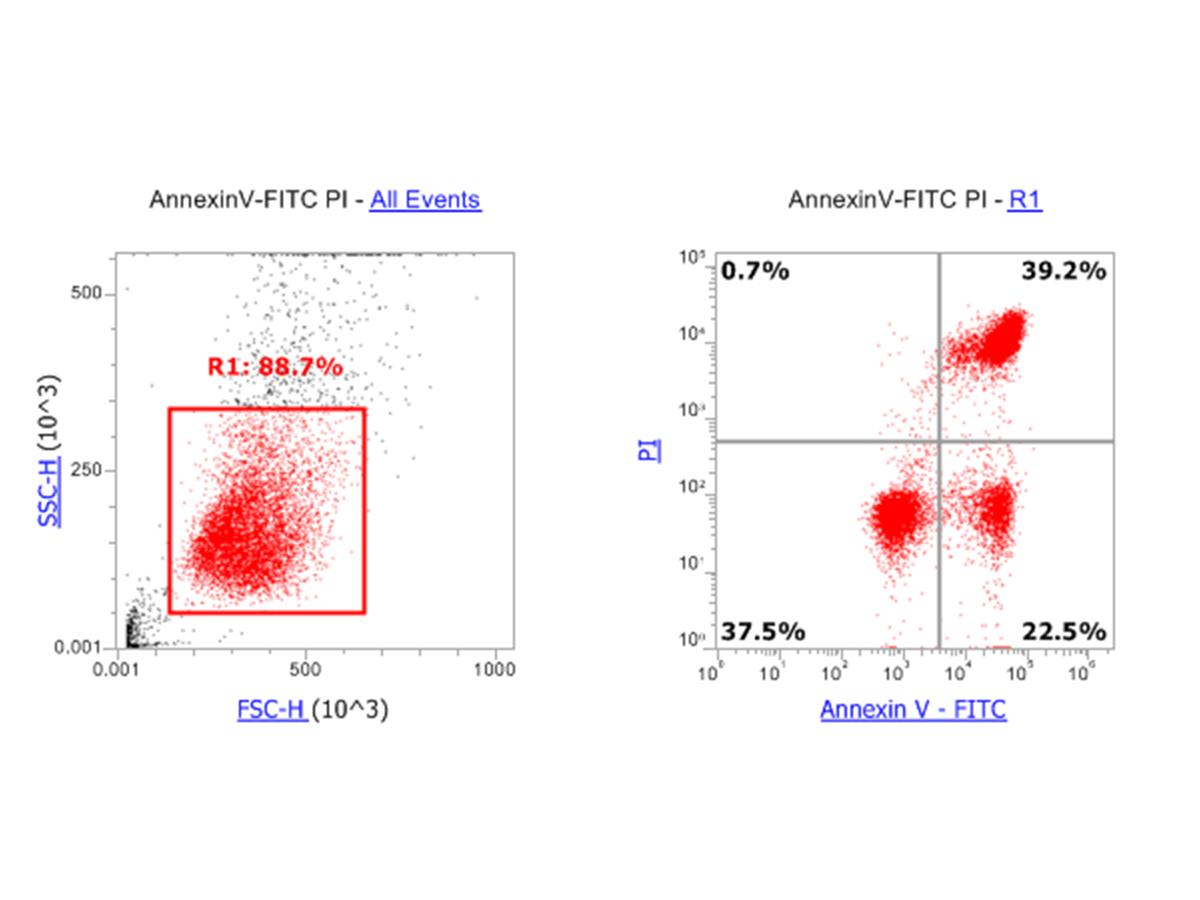
Toll样受体(TLR) 7/8小分子激动剂是抗原提呈细胞(APCs)的强激活剂,通过吞噬作用直接杀死肿瘤细胞并增强细胞毒性T淋巴细胞(CTL)的浸润。它们作为癌症免疫治疗的免疫调节剂正在被深入研究。特别是咪唑喹啉(IMQ),已被美国食品和药物管理局(FDA)批准用于治疗基底细胞癌,是一种很有前途的治疗乳腺癌和结直肠癌的药物。
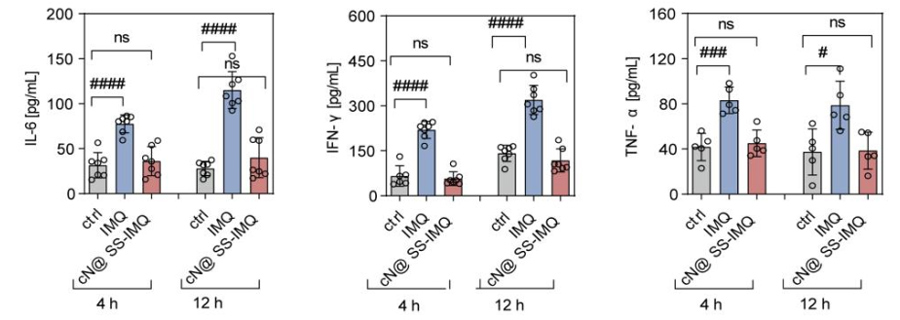
然而,IMQ等小分子激动剂在全身给药时,往往会引起剂量依赖的免疫相关不良反应(irAEs),包括致命的细胞因子风暴,从而限制了其临床应用。因此,研究人员不断探索如何实现位点特异性免疫激活,并避免由强效小分子TLR激动剂引起的不期望的全身炎症。
来自山东大学的研究团队在期刊Angewandte Chemine上发表了题为Tumor-Selective Activation of Toll-Like Receptor 7/8 Agonist Nano-Immunomodulator Generates Safe Anti-Tumor Immune Responses upon的学术论文,他们合成了具有安全的系统性靶向传递潜力的纳米免疫调节剂(cN@SS-IMQ)。
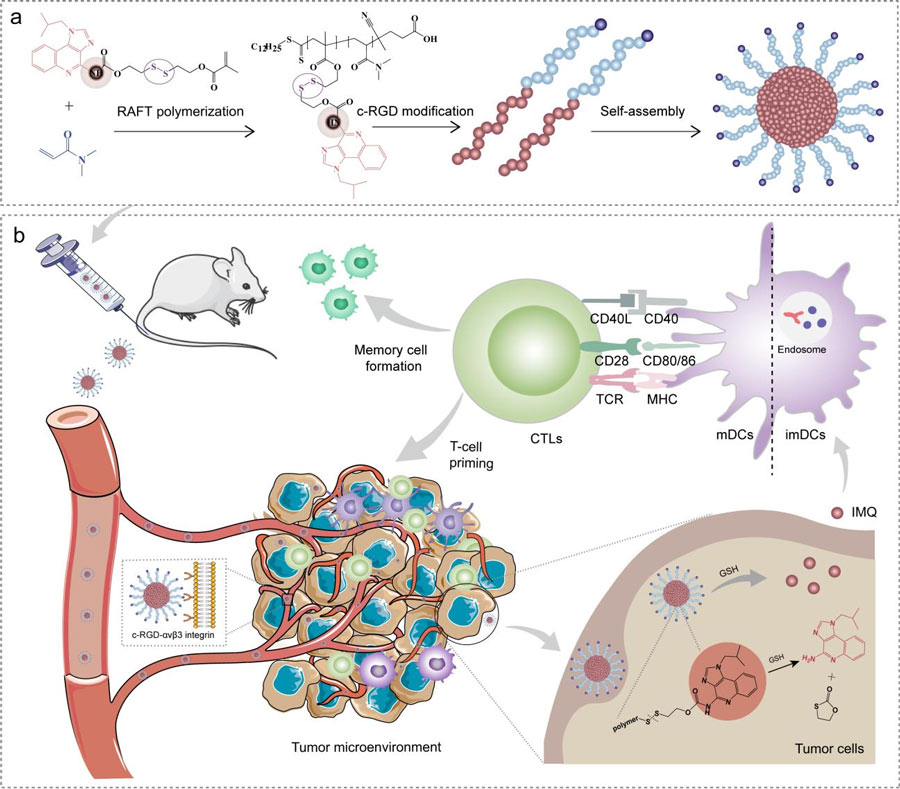
研究团队报告的GSH可激活的IMQ偶联c-RGD修饰的纳米免疫调节剂(cN@SS-IMQ),在限制肿瘤外刺激的同时,在肿瘤内可诱导更大的免疫激活。通过自组装c-RGD两亲性嵌段共聚物,由亲水性隐身聚合物,聚(N,N-二甲基丙烯酰胺)(pDMA)和疏水性IMQ连接聚(2-((2-羟乙基)二硫酰)甲基丙烯酸乙酯- IMA) (pIMQ (SS))组成cN@SS-IMQ。
通过引入c-RGD和大量的聚(DMA),进一步设计了该系统的肿瘤靶向能力和增强的血液稳定性。通过聚合载体阻断C4胺部分,消除了IMQ全身给药的致命副作用。
一旦进入肿瘤,高浓度的GSH促进原生IMQ的释放,从而促进树突状细胞(dc)的成熟,进一步增强T淋巴细胞对肿瘤的浸润。这些观察结果表明,GSH反应性单体前体在安全的全身癌症免疫治疗中具有广泛的通用性。
文章引用产品列表
-
- EK282
- ELISA试剂盒
Mouse TNF-a ELISA Kit检测试剂盒(酶联免疫吸附法)
- ¥1,600.00 – ¥10,800.00
-
- EK280
- ELISA试剂盒
Mouse IFN-gamma ELISA Kit检测试剂盒(酶联免疫吸附法)
- ¥1,600.00 – ¥10,800.00
-
- EK206
- ELISA试剂盒
Mouse IL-6 ELISA Kit检测试剂盒(酶联免疫吸附法)
- ¥1,600.00 – ¥10,800.00