截至2022年1月6日,新型冠状病毒(COVID-19)已在219个国家或地区造成2亿9千多万例感染,545多万人死亡(CDC、WHO、ECDC)。目前, 正在开发或进行人体临床试验的新型冠状病毒感染症疫苗有250多种,获批上市或紧急使用的新冠疫苗总量已达16款 。
这些疫苗对储存条件有较高要求,在室温下只能维持几个小时。然而,许多欠发达国家或发展中国家缺乏用于免疫的温控运输和储存设施且还面临着卫生保健工作者短缺的困境。防控COVID-19是全人类的挑战,疫情在一个地区失去控制,必然波及全球。因此,开发使COVID-19疫苗更稳定、更方便接种的方法意义深远。

近日,国家纳米科学中心的研究团队在期刊ACSNANO上发表了题为:Separable Microneedle Patch to Protect and Deliver DNA Nanovaccines Against COVID-19的研究论文(IF=15.881)。该研究报道了一种可分离的微针(SMN)贴片,用于传递聚合物包裹的DNA疫苗和有效免疫佐剂,诱导强效持久的适应性免疫。其在室温下可保存30天而不降低免疫活性。

产生中和性抗体对于保护人们免受病毒感染至关重要。此外,在病情较轻的COVID-19急性和恢复期患者中发现了SARS-CoV-2特异性T细胞应答。基于此,研究团队猜测免疫兴奋剂与SARS-CoV-2疫苗联合使用可能会更好地激活T细胞应答,从而起到更有效的保护作用。
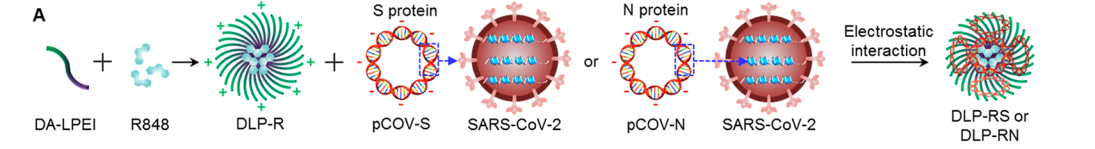
Resiquimod (R848)模拟了病原体相关的分子模式,并已被用作人类抗病毒感染的免疫刺激.。然而,如何将这种疏水佐剂和DNA疫苗(亲水性一起)输送到淋巴结以提呈病毒抗原是个难点。
研究团队通过合成脱氧胆酸共轭低分子量聚乙烯亚胺(LPEI, DA-LPEI),形成两亲性聚合物,将R848包封在纳米颗粒中(DLP-R)。通过静电作用将S-或N-蛋白的编码DNA疫苗吸附到DLP-R纳米颗粒表面(DLP-RS or DLPRN)。
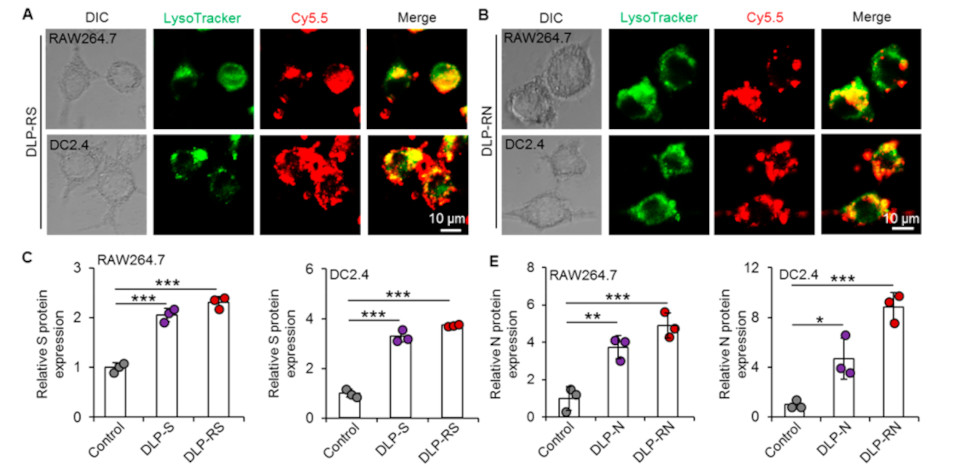
PEI的细胞毒性是应用中的一个重要问题。为了解决这个问题,研究团队采用DA-LPEI增强其转染效果,降低细胞毒性。体外实验测定DA-LPEI和制备的纳米颗粒的细胞毒性以及内/溶酶体逃逸能力。结果表明,DLP纳米颗粒对细胞无毒,并能成功帮助DNA疫苗逃离内/溶酶体“攻击”,在APC中呈现病毒抗原。
与肌肉组织相比,皮肤是理想的免疫部位,因为它具有丰富的APC和免疫辅助细胞用于诱导有效和持久的适应性免疫。虽然研究已经证明了皮内注射疫苗的好处,但使用传统方法很难实现精确和可重复注射到皮内层。
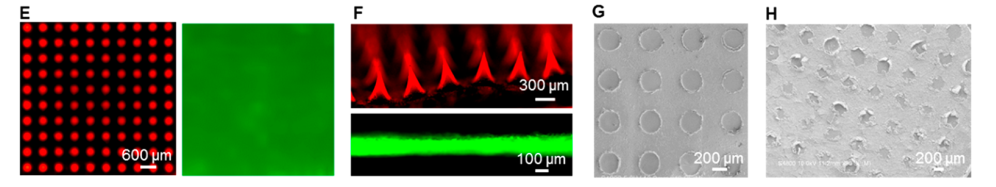
为了解决这些局限性,研究人员将纳米颗粒包装在SMN贴片中。SMN贴片由聚醋酸乙烯酯(PVA)组成,可以无痛地穿透表皮进入真皮层。由于PVA不能立即溶解于液体溶液中,他们在背衬层和微针之间设计了一个隔离层。通过将皮肤温度降低到14 - 16°C几分钟,将背衬层与皮肤分离。
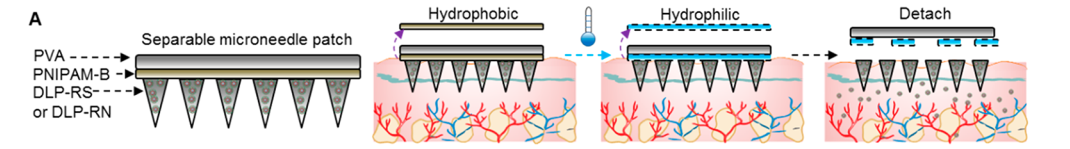
进一步地,他们评估了SMN贴片的皮肤穿透能力及可分离能力,FITC荧光及SEM成像结果表明贴片可将纳米颗粒输送到皮内层,避免损伤神经和血管结构;通过温度控制分离层可以快速高效地将SMN贴片与微针分离。
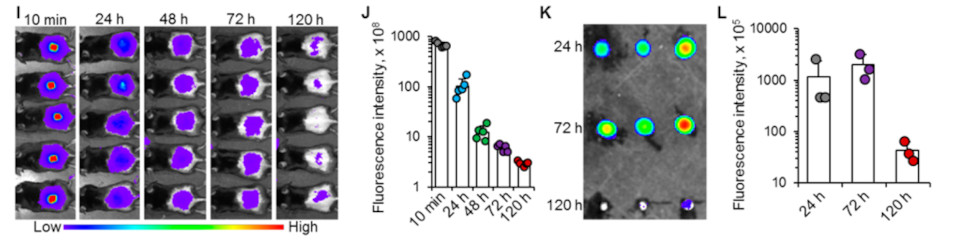
接下来,研究团队用IVIS动物成像技术研究了注射的纳米颗粒的生物分布并通过将SMN贴片于室温保存30天。结果显示,DNA疫苗在微针中是稳定的,并可以在室温下保存至少一个月。
适应性免疫系统是抵抗大多数病毒感染的重要防御。研究团队在C57BL/6小鼠中,使用SMN贴片将DLP-RS或DLP-RN纳米颗粒递送至小鼠背部真皮层,并对其免疫原性进行了评价。多指标分析结果表明通过皮内或淋巴结靶向给药可以获得更好的免疫应答;与肌肉注射的纳米颗粒相比,用SMN贴片递送DLP-RS纳米颗粒可诱导更好的免疫反应。
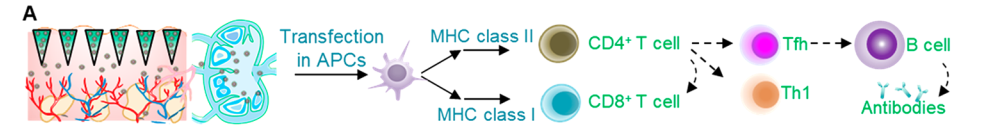
进一步地,他们研究了SARS-CoV-2特异性T细胞免疫应答并检测治疗小鼠血清中的中和抗体。结果表明免疫刺激剂可能有助于潜在的体液免疫反应;携带DNA疫苗的补丁可以在室温下储存而不降低其免疫能力。

总而言之,研究团队开发了一种基于微针的DNA疫苗,在APC中表达S-和N -蛋白,触发免疫应答,阻断SARS-CoV-2病毒的感染。此外, 该疫苗在室温下储存至少2周后可有效诱导免疫应答并且在体内接种期间没有观察到任何明显的副作用。
联科生物 产品助力

联科生物专业从事ELISA试剂盒研发生产十余年,种类多样,质控严格,助力科研。更多信息请点击官方网站或与我们联系。