器官移植是用来自供者的同种异体或自体器官来替代受者受损或缺失的器官。这是治疗终末期器官衰竭最有效的方法,有时也是唯一可用的方法。然而,同种异体移植存在不可避免的宿主与移植排斥反应,严重影响移植器官的生存,降低了受者的生活质量。

一般要求接受异体器官的患者无限期地服用免疫抑制药物(immunosuppressive drugs, IS),以抑制整体免疫,延长术后排斥反应,提高移植器官的存活率。然而,由于缺乏对靶细胞的特异性和选择性,大多数IS在缓解急性排斥反应方面是低效甚至无效的,长期服用可能会损害系统免疫,甚至有诱发严重并发症的风险,如骨髓抑制、机会性感染、代谢综合征和肾脏损伤。因此,迫切需要一种高效、低毒的新型免疫抑制策略。
近日,发表在Biomaterials上的研究论文Targeted regulation of lymphocytic ER stress response with an overall immunosuppression to alleviate allograft rejection中,来自浙江大学的研究团队构建的ER靶向脂质体,可将UPR传感器的小分子抑制剂高效地输送到淋巴细胞的ER中,抑制IRE1α,从而诱导整体免疫抑制,获得了更好的异体皮肤移植结果。

未折叠蛋白反应(Unfolded protein response, UPR)是促进内质网(endoplasmic reticulasis, ER)蛋白平衡重构的最保守的适应机制之一。IRE1α轴作为最保守的UPR分支,主要通过提高细胞的蛋白加工能力来减轻ER负担,它广泛参与多种免疫细胞的生物活性,包括T-/B-淋巴细胞的发育和活化反应、树突状细胞的抗原呈递、 巨噬细胞的极化和NK细胞的效应功能,具有出调节重塑系统免疫的潜力。
研究团队发现淋巴细胞介导的异体移植排斥反应通常伴有淋巴细胞内质网应激反应的过度激活。然而,目前还不清楚UPR,尤其是IRE1α在淋巴细胞相关移植排斥反应中的作用。基于此,他们假设调节淋巴细胞的UPR可能是一个潜在的治疗突破在异体移植,并在前期对ER靶向纳米载体的研究基础上,制备了具有或不具有ER靶向能力的亲脂性ATP竞争IRE1α激酶抑制核糖核酸酶衰减剂(KIRA6)负载脂质体。分别命名为KIRA6@lipoT和KIRA6@lipoN。
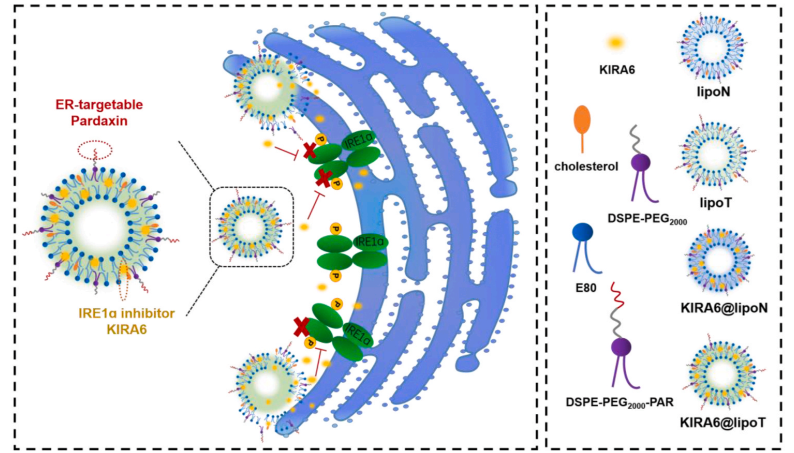

激活免疫通常伴随着多个免疫细胞应激反应的上调,抑制淋巴细胞UPR可能会损害整体免疫。为了验证假设,研究团队采用小鼠抗肿瘤模型监测全身免疫,测量指标多面性。结果表明淋巴细胞UPR紊乱导致的免疫抑制和CD8+ T细胞(T-8)生物学改变之间有密切的相关性。
接下来,研究团队采用小鼠脾淋巴细胞(SPLCs)进行体外研究,更直观地了解UPR与淋巴细胞尤其是T-8生物活性之间的相互关系。他们认为存在阶段选择性的UPR参与。另外,应力耐受性也可能存在亚群差异,其中不同T-8亚群的适应性为:memory > naïve > effector > terminal effector。
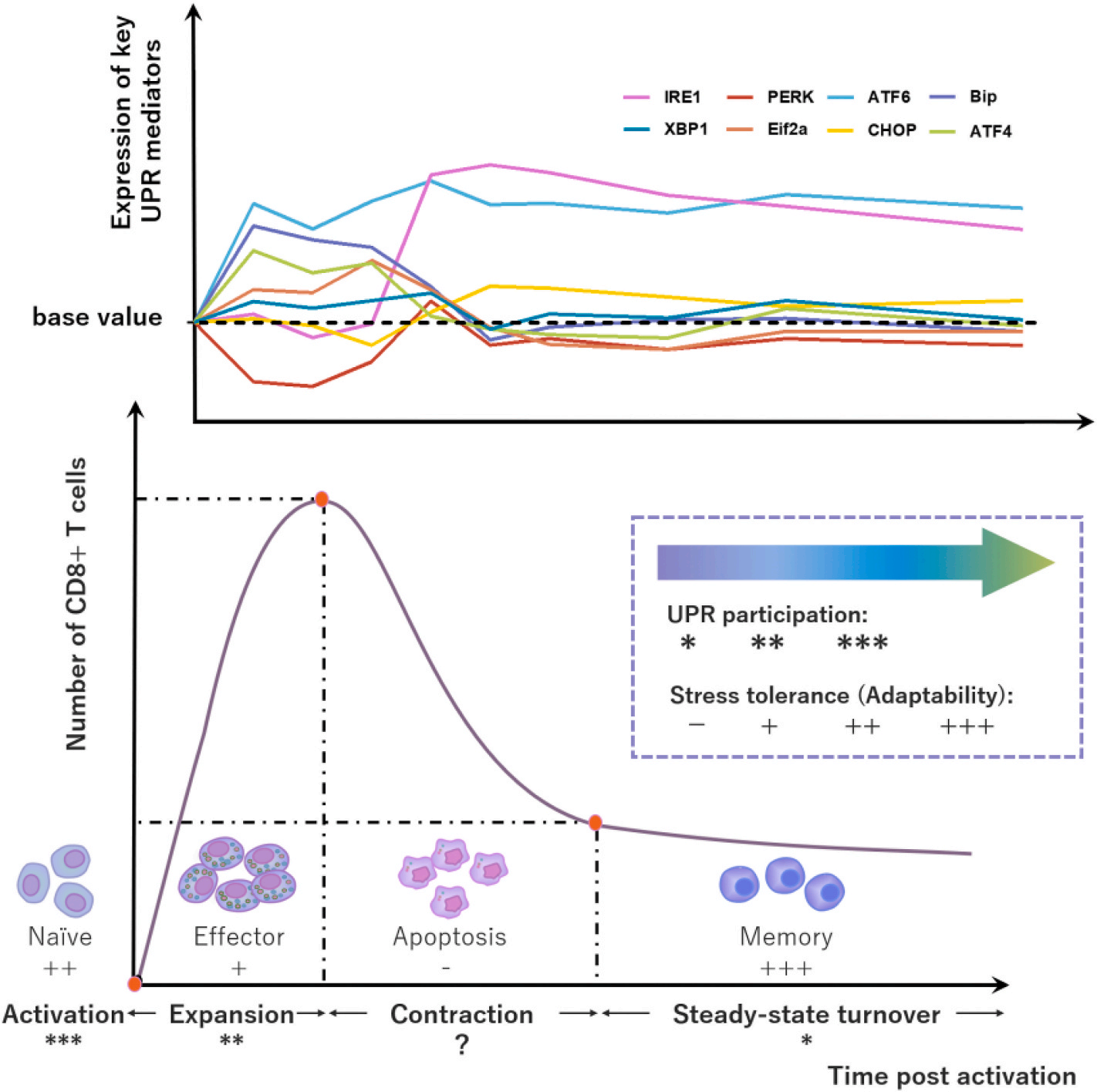
进一步地,研究团队将他克莫司(FK506)加到非ER靶向的lipoN上(FK506@lipoN),利用鼠同种异体皮肤移植模型研究淋巴细胞IRE1α抑制对移植排斥反应的影响。结果表明,淋巴细胞IRE1α抑制可诱导整体免疫功能的抑制,从而提高了移植物的相容性,这与有限效应和记忆T-8有关。 此外,IRE1α的失活和钙调神经磷酸酶的抑制具有协同免疫抑制作用,在同种异体移植排斥反应的抢救中具有广阔的应用前景。

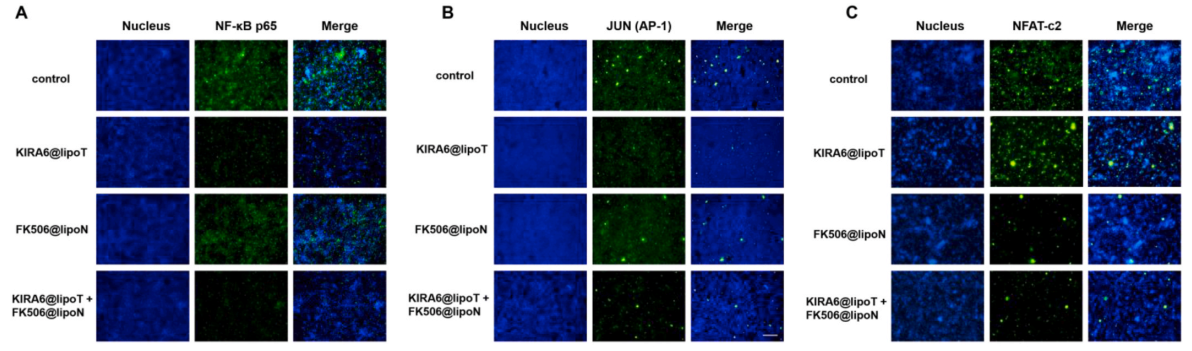
KIRA6是一种ATP竞争的IRE1α激酶抑制RNase的衰减剂,它干扰TRAF2的招募,并破坏下游AP-1和NF-κB的激活。鉴于此,研究团队推测KIRA6与FK506的协同作用可能在于它们协同调控炎症信号通路,并确定了不同制备处理的SPLCs对NF-κB p65、c-JUN (AP-1)、NAFT-c2的表达水平影响。结果显示,IRE1α失活和钙调神经磷酸酶抑制的协同免疫抑制作用是通过炎症因子与UPR的交互作用实现的。
联科生物 产品支撑