https://www.liankebio.com/article-information_Tech-650.html
作者:QIAGEN官网 发布日期:2015-03-21 10:00
|
活菌 PCR 是一项崭新的技术,能够选择性地扩增存活细胞的 DNA。这使得研究人员能够快速、可靠地区分存活和死亡细胞,而不再依赖耗时的培养方法进行判断。
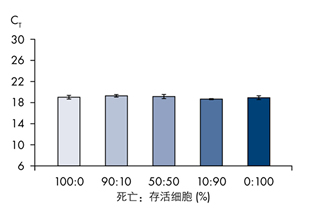
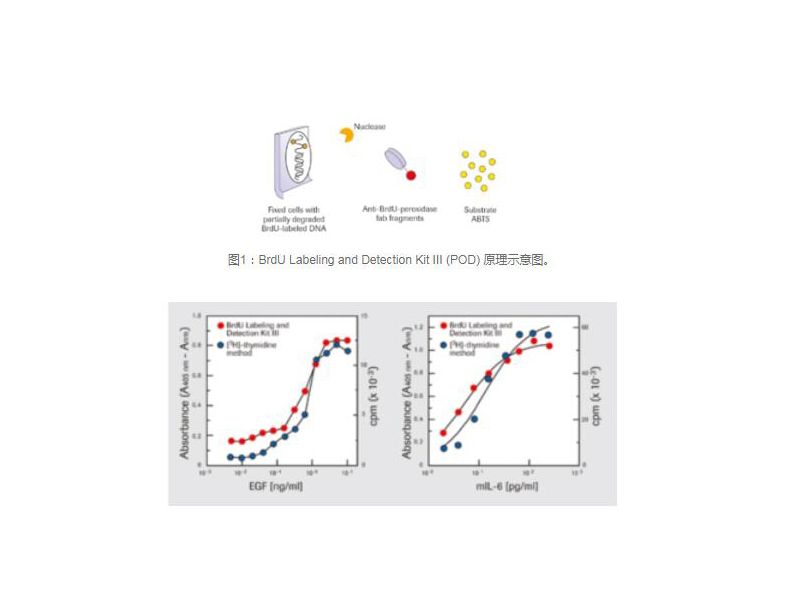
传统 PCR 法的缺陷 传统 PCR 法的一个主要缺点就是无法分辨存活和死亡的微生物。这会导致误导性结果的生成,例如高估污染水平。此外仅对于存活微生物,传统方法也无法胜任精确的定量检测工作(图 3)
PMA 对存活和死亡细胞具有高效的分辨能力 PMA 选择性地进入死亡细胞,由光激活进而嵌入 DNA 并与之共价结合,从而在后续 PCR 中强烈抑制扩增反应。由死亡细胞 DNA 获得的 CT 信号显著高于存活 DNA,据此实现存活和死亡细胞的明确区分(图 4)。
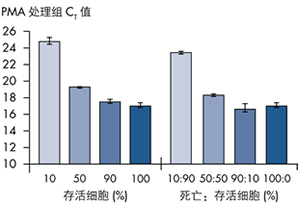
PMA 选择性抑制死亡细胞 DNA 的检测 当使用存活和死亡微生物的混合样本时,PMA 可选择性地抑制对死亡细胞的检测,而不会对存活细胞 DNA 的检测造成影响(图 5)。样本中的死亡细胞不会影响 PMA 的性能。因此可确信,所得到的结果能够精确反映样本中的存活微生物。
PMA 对存活和死亡细胞具有高效的分辨能力 PMA所具有的存活和死亡细胞分辨能力,能确保您可以轻松、绝对肯定地衡量自身灭菌控制措施的有效性。比较存活和死亡沙门氏菌混合样本的 PMA 处理组与未处理组 CT 值差异(ΔCT)时,我们发现,较高 CT值的最大信号位移可达 15 左右。这一显著性的信号分离事件可用于明确区分 PMA 结合的死亡细胞 DNA 与 PMA 未结合的存活细胞 DNA。而这一分辨能力在样本中存活细胞比例变化较小的情况下仍然有效。这将确保您可以轻松并绝对、肯定地衡量自身灭菌控制措施的有效性。
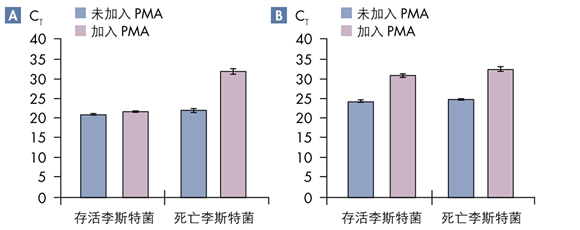
PMA 技术在混浊介质中实现高效检测 使用光激活化合物时存在的一个问题是,如何在性能不够理想的浑浊介质中实现细胞活性检测。好在,激活 PMA 所使用的波长能够穿透浑浊介质。 我们在一项针对李斯特菌的分析配置中加入了对照 DNA(掺入(spiked-in)DNA),以确保 PMA 试剂的效能和实现正确操作。PMA 处理组与非处理组样本之间对照 DNA CT 值的比较结果可用来证实 PMA 试剂的效能及操作的正确性。图 7 显示了 PMA 存活 / 死亡细胞区分流程的检测结果,这些结果中包含了对热灭活与存活李斯特菌混合样本中靶标通道和对照 DNA(对照通道)的检测。在靶标通道中,存活李斯特菌样本PMA 处理组与非处理组之间 CT 值不存在差异,这与实验预期一致。在死亡李斯特菌样本中引入 PMA 处理会导致 CT 结果值出现预期性上升,这是 PMA 成功嵌入 DNA 的后续结果(图 7A)。在对照通道中,掺入到李斯特菌样本中的 DNA 显示了预期为 6 左右的的 CT 值移动,其移动范围仍处于特定的 6±2 区间内,说明该结果并未受到所使用的 Nutella®介质影响(图 7B)。 这些数据清晰证明了 PMA 的激活光强足以穿透混浊样品,并能成功介导 DNA 的嵌入反应。
|