截至目前,已有十余种寡核苷酸药物获得美国食品药品监督管理局(FDA)批准;多为反义寡核苷酸和短干扰RNA (siRNA)药物。靶向寡核苷酸的传递效率,包括细胞不渗透、核酸酶降解和溶酶体逃逸失败仍然是研究的挑战。为了克服这些技术难点,人们设计了多种保护siRNA的载体,包括脂基纳米颗粒、高分子材料和无机纳米载体。由于具有大量的自组装、高生物物理可控性和可行的定制优化等优势,DNA纳米结构在寡核苷酸纳米颗粒传递体系中具有独特优势,特别是四面体框架核酸(tFNAs),它们被认为是具有巨大研究潜力的药物传递工具。

近日,来自四川大学华西口腔医学院的研究团队在期刊Advanced Materials上发表了题为:
A Lysosome‐Activated Tetrahedral Nanobox for Encapsulated siRNA Delivery的研究论文。该研究制作的纳米盒为siRNA提供了一种动态pH敏感性传递系统,并可作为其他小RNA的扩展策略。
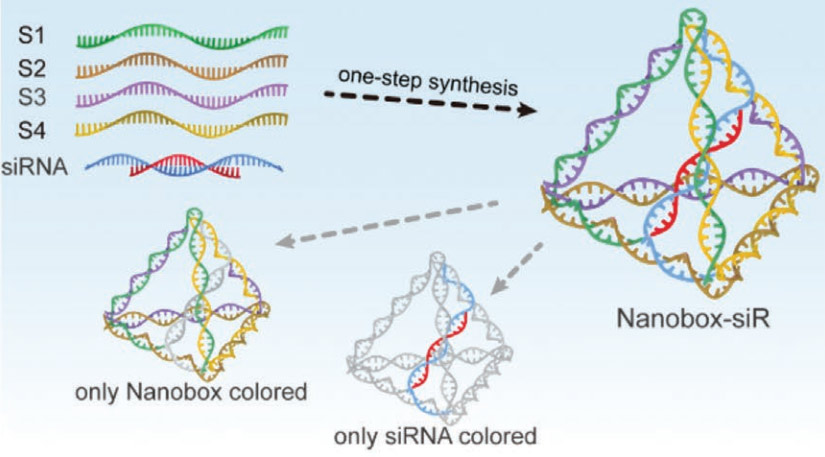
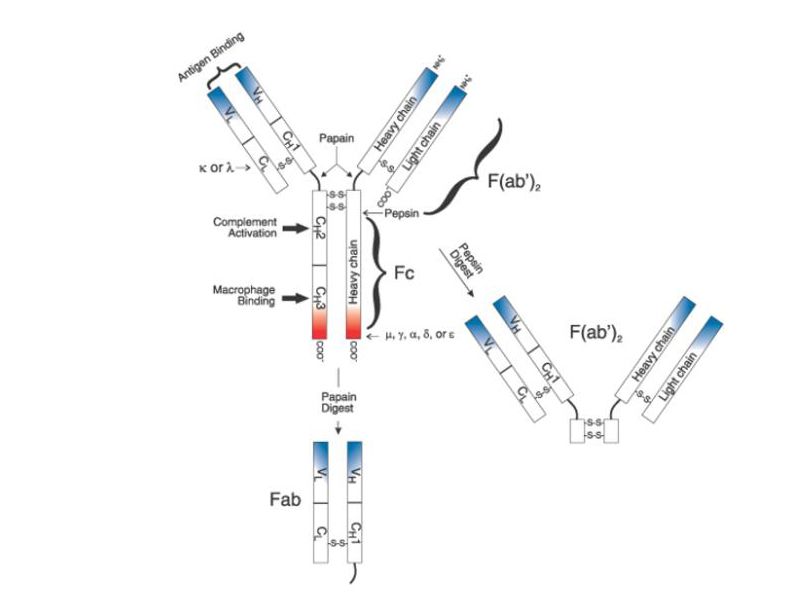
受四面体支架内部原始稳定空间的启发,研究团队制造了一个动态溶酶体激活的tFNA纳米盒,用于封装短干扰RNA (siRNA)。为了探索纳米盒的传递能力和基因沉默效应,他们选择肿瘤坏死因子α (TNF-α)为靶点,将靶向TNF-α的siRNA (nanobox- sir)转染到富含溶酶体的巨噬细胞中。封闭的四面体结构赋予siRNA更强的抗RNase和血清的能力,并使其在运输过程中与运载工具牢固集成。此外,纳米盒的pH响应开关允许siRNA在细胞培养温度下进入溶酶体时受控释放。nanobox-siR显著下调脂多糖(LPS)刺激下TNF-α的mRNA水平,表现出与Lipofectamine3000转染siRNA (Lipo3000-siR)相当的基因沉默效果。炎症相关的各种分析也表明,nanobox-siR可以抑制炎症诱导反应,这在体内实验中进一步得到证实。就文中研究的纳米盒而言,所选择的30 bp边长可以适应长达25 bp的寡核苷酸,包括大多数dicer-substrate siRNA甚至miRNAs。
MULTISCIENCE产品支撑:

文章引用产品列表
-
- EK282
- ELISA试剂盒
Mouse TNF-a ELISA Kit检测试剂盒(酶联免疫吸附法)
- ¥1,600.00 – ¥10,800.00