https://www.liankebio.com/article-information_Tech-670.html
作者:QIAGEN官网 发布日期:2015-03-09 07:00
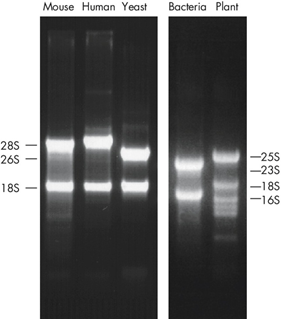
 RNA定量 在检测RNA样本时,需确保比色杯中去除了RNA酶,特别是在使用分光光度测定之后仍需回收这些RNA的情况下。该条件可通过使用0.1 M NaOH,1mM EDTA和不含RNase的水的顺序洗涤来实现。使用稀释RNA的缓冲液为分光光度计设定空白对照。 使用分光光度法测定RNA浓度 在使用紫外通透的塑料比色杯的分光光度计中,测量260 nm的吸光值(A260)以确定RNA的浓度。为了确保获得有意义的结果,读值应在0.15与1.0之间。在260 nm波长下,1个单位的吸光值对应每毫升44 µg的RNA浓度(A260=1 → 44 µg/ml;基于标准的1 cm测光距离)。这一相关性仅对中性pH值条件下的检测有效。因此,如需稀释RNA样品,则应使用中性pH值的低盐缓冲液(例如10 mM Tris•Cl ,pH7.0)。 在检测RNA样本时,需确保比色杯中去除了RNA酶,特别是在使用分光光度测定之后仍需回收这些RNA的情况下。这可以通过使用0.1 M NaOH,1mM EDTA和不含RNase的水的顺序洗涤来实现。使用稀释RNA的缓冲液为分光光度计设定空白对照。列举一个RNA定量中的计算实例如下: RNA定量举例 RNA样品的体积= 100 µl 稀释=10 µl RNA样品+490µl 10 mM Tris•Cl ,pH 7.0(1/50的稀释比) 使用1 ml(已去除RNA酶)比色杯,检测稀释后样本的吸光度 A260 = 0.2 RNA浓度 = 44 µg/ml x A260 x稀释系数 = 44 µg/ml x 0.2 x 50 = 440 µg/ml RNA总量 =浓度x以毫升为单位的样品体积 = 440 µg/ml x 0.1 ml = 44 µg RNA 确定RNA的品质 RNA纯度 在260 nm与280 nm读值之间的比例(A260/A280)能够反映RNA的纯度,因为如蛋白一类的污染物会吸收紫外光。不过,A260/A280的比值也受到pH值的显著影响。当使用没有缓冲能力的水时,pH值与A260/A280的比值结果都会发生大范围的改变。 较低的pH值会导致A260/A280的比值变小,对蛋白质污染的敏感性也会随之降低(3)。 为了获得精确的比率,我们建议在微碱的低盐缓冲液中检测吸光度(例如10 mM Tris•Cl,pH7.5)。在10 mM Tris•Cl,pH 7.5缓冲液当中,纯RNA的A260/A280 比率约为1.9–2.1。 注:某些分光光度计在检测纯RNA时,可常规获得高达2.3的比值。 请确保使用同种溶液校准分光光度计。不过,为了准确确定RNA的浓度,我们仍建议使用中性缓冲液稀释RNA样本,因为吸光度和浓度(A260读值为1相当于44 µg/ml的RNA浓度)之间的关系是一个基于中性条件获得的吸光系数。 RNA的完整度 总RNA的完整度和大小分布可以通过变性的琼脂糖凝胶电泳、溴化乙锭染色或市售的检测系统(如QIAxcel系统或Agilent 2100 )进行检测。每条核糖体RNA的富集区域在凝胶染色之后应显现为锐利的条带。28S核糖体RNA的条带亮度应为18S rRNA条带的两倍左右。如果某一泳道中核糖体RNA条带不够锐利,却出现小尺寸RNA的弥散情况,则很可能因为RNA样品在制备过程中发生了严重的降解。 Agilent 2100 Bioanalyzer也能够提供RNA完整数目(RNA Integrity Number,RIN)这一参数,作为对RNA完整度的一个有用量度。在理想情况下RIN值应接近10,不过在许多情况下(特别是对组织样本来说),RNA品质主要取决于原始样本的保存情况。 不同来源的核糖体RNA大小
RNA分析:分析凝胶 变性凝胶分析的原理 利用RNA在甲醛琼脂糖凝胶中的电荷迁移效应,可对RNA进行分离和鉴定。RNA不像DNA,它们具有复杂的二级结构,因此需使用变性凝胶。凝胶中的甲醛能够破坏RNA的二级结构,从而使得RNA分子严格按照电荷迁移的方式得到有效分离。 在电场中,主链磷酸基团上所携带的负电荷使核酸分子向阳极移动。变性的RNA分子的迁移速率取决于它们的尺寸大小;不过片段大小与迁移速率之间并非线性相关,因为更大的片段会遇到更大的摩擦阻力,在凝胶中移动更为困难。 琼脂糖凝胶分析是最为常用的RNA分析方法,通常依据RNA的大小相应选择合适分辨范围的琼脂糖凝胶。小的RNA片段,如tRNA或5S rRNA,可以使用聚丙烯酰胺凝胶电泳进行分析。可查阅分子生物学手册(2,4)以获得关于各类分析胶的详细信息。本节将针对甲醛琼脂糖凝胶电泳进行介绍。 制备用于RNA分析的甲醛琼脂糖凝胶 下列甲醛琼脂糖(FA)凝胶电泳方案能够提高凝胶分离及后续检测(例如RNA印迹)的灵敏度。本方案的关键特点在于使用了浓缩的RNA上样缓冲液,从而(相比传统实验方案)能够向凝胶中载入更大量的RNA样本。琼脂糖 用于制备凝胶的琼脂糖是针对所分离RNA片段的大小来确定浓度范围的。对于大多数的目的RNA种类来说,使用1.0–1.2%(质量体积比)的琼脂糖浓度可获得最佳结果。对于较大的mRNA种类,降低琼脂糖浓度可能会有所帮助。如需分离更小的mRNA,琼脂糖浓度可提高至2%。对于较小的RNA种类,如tRNA或rRNA,则推荐使用聚丙烯酰胺凝胶电泳。 请使用超纯琼脂糖,因为如多糖类、盐类和蛋白一类的杂质都会对RNA的迁移造成影响。 小贴士:某些电泳槽的塑料不耐乙醇。请对此适当留意,并核对厂商的说明书。
|