https://www.liankebio.com/article-information_Tech-2835.html
作者: PeproTech 发布日期:2019-12-31 10:00
|
小鼠小肠类器官的培养说起来容易,操作起来好像也并不是那么简单的,小肠类器官的培养较为繁琐,尤其是获取原始干细胞操作步骤多、操作时间长,而且培养过程中也有颇多注意事项。对于初学者来说,此实验并不是那么友好,稍不注意一些操作细节,很可能导致培养失败。 但是!别怕! PeproTech技术员已经亲自实践操作,趟过一遍泥泞的路~呕心沥血总结了非常全面的小鼠小肠类器官的培养方法和注意事项, 快点读起来吧! 一、前 言 小肠类器官的培养可以通过多能诱导干细胞或胚胎干细胞来诱导分化,也可以取小肠的隐窝干细胞来诱导分化。目前大多数研究都是采用小肠隐窝干细胞来培养,因为该方法不仅获取干细胞方便,对技术的要求不高,而且培养的类器官传代次数更多,可以在体外长期培养长达2个月之久。 二、小 肠 类 器 官 的 制 备 方 法 2)使用小剪刀,将肠段纵向切开,肠腔朝上打开。用冰冷的PBS(2-8°C)轻轻洗涤切开的肠道片段,用玻片刮出肠管内容物和绒毛结构,再次用冰冷的PBS冲洗; 3)向50 mL离心管加入15 mL冰冷的PBS。用镊子夹住肠道一端,并悬在管口上。从肠道底部开始,用剪刀将肠切成1~2毫米的小片,让这些碎片落入管内的缓冲液中; 4)用PBS预先润湿10 mL移液管,加入15 mL冰冷的PBS清洗肠道碎片5~10次,直至上清液变澄清;
5)除去上清液,将组织碎片重悬于25 mL小肠隐窝消化液中,在冰上孵育20 min,冰盒置于20 rpm转速摇床上旋转30 min; 小肠隐窝消化液:2-5 mM的EDTA, 此步骤后可以让组织碎片自然沉降后去除上清,继续消化一次。 6)让组织碎片通过重力沉降约1 min。小心吸出并丢弃消化液,留下足够的液体以没过组织碎片; 7)将组织碎片重悬于10 mL10%FBS冷的(2-8℃)PBS缓冲液,并用移液管上下吹打三次。静置直到大部分肠组织碎片沉降到底部;
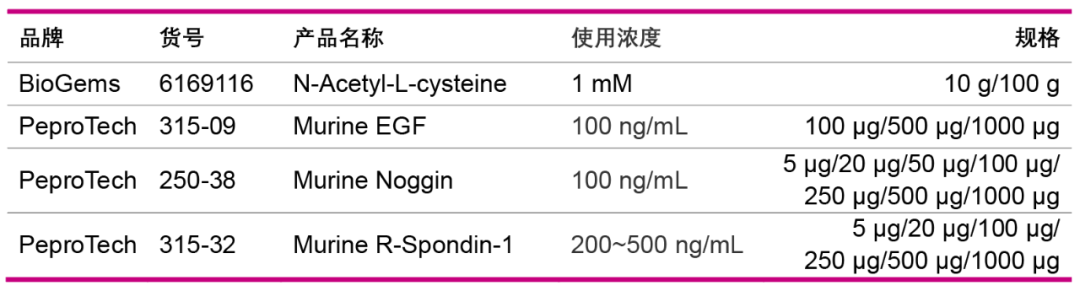
8)小心吸取上清液并使用70 μm滤网过滤,将滤液收集于干净的50 mL管中; 9)重复上述7-8二次,将获得的三份过滤液混合; 10)在2-8 ℃下将上述混合液以290×g离心5分钟。小心地倒出并丢弃上清液; 11)将沉淀重悬于含有10 mLPBS缓冲液中。200×g离心3分钟。轻轻倒出上清液。将肠隐窝沉淀留在管中。根据沉淀量加入适当体积的基础培养基重悬沉淀,如果单细胞过多,可200 r /min 离心2 min 收集上清以去除单细胞; 12)计数,吸取10 μL置于玻璃载玻片或血细胞计数器上。使用倒置显微镜,计数10 μL样本中的隐窝数量,200 g离心5 min,小心吸出并弃去上清; 配 制 类 器 官 培 养 基 在基础培养基中加入:
13)用类器官培养基将隐窝的密度重悬至8-20个/μL,取出150 μL隐窝悬液,加入等体积的未稀释的基质胶混合隐窝,小心地上下吹打十次以充分混匀,注意避免产生气泡; 14)吸取50 μL悬液,加入到提前预热的24孔板每个孔中的中心部位,样品应在每个孔的中心形成圆顶结构。为了防止接种时出现气泡,枪头内液体不要全部打出; 15)将培养板在37 °C下静置10分钟以待基质胶完全凝固。将平板转放入培养箱时,应注意不要破坏凝固后的液滴;
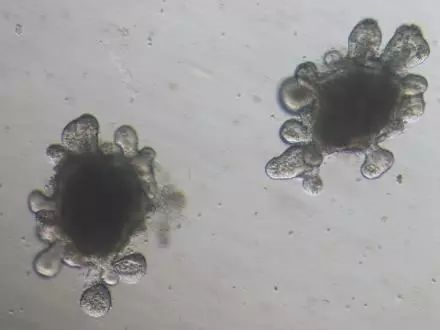
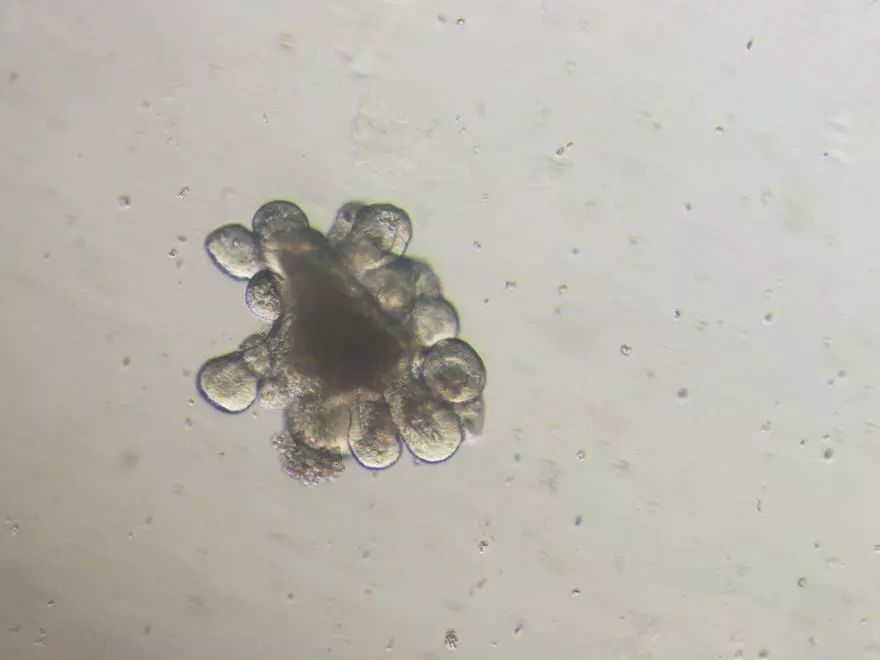
16)使用移液枪沿着孔侧壁向每个孔中轻轻地加入500 μL室温(15-25℃)的配置的类器官培养基。不要将培养基从圆顶结构上直接加入; 17)向其它未接种的孔中加入无菌PBS以保证培养时的湿度。 将培养板的盖子盖好,并在37 ℃和5%CO2下进行培养; 18)观测类器官生长情况。通常,隐窝开始培养约3小时后形成球状结构,通常在培养2至4天后,小肠类器官开始出芽,并且在第5至7天形成复杂的出芽状结构; 19)隔天进行完全换液。换液时将移液枪头放在孔底边缘小心地将原有液体培养基吸出,并加入为500 μL新鲜的室温类器官培养基。
三、小 肠 类 器 官 培 养 注 意 事 项 2)用注射器往肠腔内注入PBS,冲洗掉小肠内容物,可以减少后续洗涤时间; 3)用无菌的载玻片刮去小肠内绒毛组织,尽量去除干净,可以减少杂细胞的产生,另外可以有助于小肠组织的消化,得到更多的小肠隐窝; 4)小肠隐窝消化液用5 mM的EDTA,注意EDTA是否有析出,如析出太多会影响终浓度,有必要更换新的EDTA; 5)因分离小肠隐窝需要时间较久,建议整个操作在低温进行,离心机调至4℃,PBS放冰上。试用移液器前用冷的PBS润洗移液器枪头; 6)EDTA消化后,小肠组织会变松散,在外界机械力作用下,小肠隐窝会从组织中分离出来,可以重复几次通过外界机械力作用得到不同的分馏组分,可以挑选隐窝含量较高,杂细胞较少的分馏组分种板培养; 7)得到分馏组分后进行隐窝计数,用完全培养基重悬隐窝至8~20个/uL,加入等体积基质胶混合,该过程一定要在冰上操作,混合过程切勿产生气泡,否则影响后续观察以及隐窝培养状态,混匀过程可以调小量程,吸取的液体不要全部吹出; 8)购买的基质胶在冰上融化后分装冻存,操作过程中基质胶一定要放在冰上,未用完的液体状基质胶可以冻存,若凝固后请弃去。 9)基质胶种板前需要将培养板放入培养箱温浴30min,拿出培养板后尽快种板,以便形成更好的基质胶圆顶结构。 2)将全部打碎的基质胶悬液冰上放置5~10 min;可用1 mL大枪头继续吹打悬液,此过程避免产生气泡(调制量程到700 μL可避免气泡产生),可取适量的悬液观察,直至看不到大块的类器官团块为止; 注:此过程也可将全部打碎的基质胶悬液吸入胰岛素注射器内,再将悬液通过胰岛素注射器针头打出,通过机械力将类器官团块分离。 传代中,若隐窝状态良好可进行1:3传代,若状态较差可进行1:1传代。全程可以维持约3个月的长期传代扩增,且类器官状态保持良好。
五、小 肠 类 器 官 的 冻 存 与 复 苏 1)将需要冻存的类器官冰上放置5~10 min; 2)收集类器官,步骤同之前传代收集步骤一致; 3)离心后弃上清,用800 μL的冻存培养液重悬,将悬液移至冻存管中,放入冻存盒中于-80 ℃冰箱中保存24 h,如需长久保存,则24 h后转移至液氮罐保存。 复苏准备:37 ℃水浴箱 从液氮中取出冻存管后,立即放入37 ℃水浴中,使之迅速融解。等到冻存管中仅存一小片冰室,迅速将细胞转移到含9 mL冷的基础培养基中(先将之置于15 mL离心管中,放于冰上)。200 g 室温离心5 min,弃去上清,加入适量类器官培基重悬后与基质胶混合种板,待基质胶凝固后加入类器官培养基,将培养板放入培养箱。 |
||||||||||||||||








官网800x600-3.jpg)