活性氮通过增强的硝化应激诱导生物大分子(如脂质、蛋白质和DNA)的损伤。硝化应激是一氧化氮(NO)或NO来源的活性氮(RNS)与活性氧(ROS)发生生化相互作用而产生的生物学过程。细胞内硝化应激主要是RNS的产生速度超过细胞的中和能力,通过过氧亚硝酸盐(ONOO−)、亚硝酸盐、过氧化氢或过氧化物酶途径诱导细胞内蛋白酪氨酸硝化,导致一系列细胞损伤。
研究表明,ONOO−是细胞凋亡最具潜力的氧化硝化诱导剂。当O2•−和NO在几十微米范围内产生时,二者会迅速结合形成ONOO−。ONOO−能够调节功能蛋白的数量,破坏线粒体的代谢功能,通过脂质过氧化降解膜结构,诱导DNA链断裂,破坏核酸,并削弱DNA损伤修复,增加细胞凋亡率。虽然ONOO−诱导的硝化应激在肿瘤治疗中具有优势,但是在肿瘤深部可控地生成ONOO−是一个难题。
来自哈尔滨工程大学的研究团队在期刊《Nano Letters》上发表了题为Tailoring Silica-Based Nanoscintillators for Peroxynitrite-Potentiated Nitrosative Stress in Postoperative Radiotherapy of Colon Cancer的研究论文,报道了使用可控的ONOO−增强硅基纳米闪烁体(PEG/ SCNPs @ DMSN-SNO-g-C3N4, P/SMNO-C) 提高细胞内硝化应激,有效用于结肠癌术后X射线控制的放射治疗。
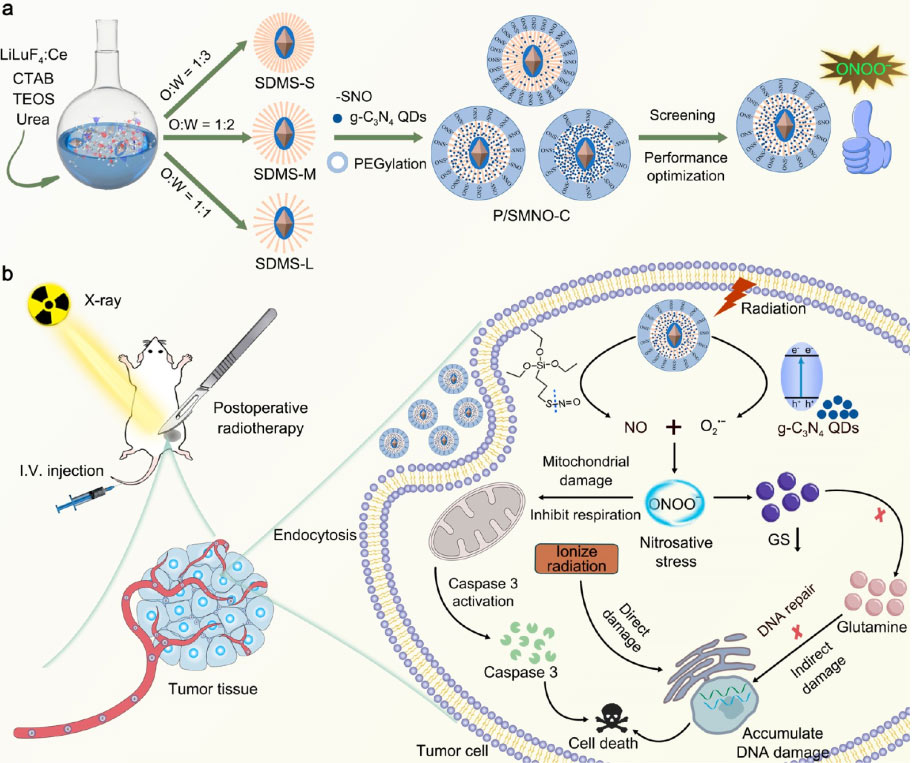
纳米闪烁体作为桥梁,一方面沉积高能X射线用于敏化RT;另一方面,它们将X射线光子转化为紫外线,唤醒周围的光敏NO供体和纳米级半导体。P/SMNO-C主要通过增加DNA损伤积累的策略发挥其抗癌作用,即直接利用高能辐射电离DNA,间接利用超载的ONOO−下调GS,导致DNA损伤修复延迟。产生的ONOO−和NO作为功能性血管扩张剂可以显著降低HIF-1α的表达,从而克服缺氧相关的辐射抗性。此外,P/SMNO-C通过ONOO−硝化作用诱导线粒体损伤,扰乱其正常代谢功能,导致caspase介导的细胞凋亡。该研究成功地构建了一种结构可调节、毒性可忽略的新型硅基过氧硝酸盐强化的硝化应激诱导系统,该系统在X射线照射下实现了体内DNA损伤的高效积累,实现了结肠癌术后低剂量放射治疗,在结肠癌术后放疗方面具有广阔的应用前景。
■ MULTISCIENCE产品支撑

文章引用产品列表
-
- AP101
- 凋亡试剂盒
Annexin V-FITC/PI Apoptosis Kit(适用于除C6以外的流式细胞仪)
- ¥630.00 – ¥1,280.00