Toll样受体(TLRs)是先天性免疫系统中高度保守的重要组成部分,表达于胞内器室的TLR3、7、8和9可识别病毒和细菌的核酸,并引发强有力的抗病毒和抗肿瘤免疫反应。通过TLR7或TLR8增强机体的先天免疫力已被证明是一种有效的抗病毒策略。R848是一种TLR7和TLR8双激动剂,是已获FDA批准的药物,用于治疗由疱疹病毒和皮肤T细胞淋巴瘤引起的皮肤损伤。这些小分子亦被视为潜在的疫苗佐剂和抗病毒试剂,但并不适用于药理研究,因为它们会导致非特异性、全局性炎症,以及注射部位附近的免疫缺陷。由于TLR8具有激活I型辅助T细胞(Th1)细胞介导免疫应答的能力,且可通过识别ssRNA病毒介导抗病毒免疫,被认为是一个十分重要的靶点。但TLR8的选择性调节剂的设计一直是个挑战。

近日,清华大学团队在著名期刊Nature Communications上发表了题为:Tetrasubstituted imidazoles as incognito Toll-like receptor 8 a(nta)gonists的研究论文(IF=14.919,综合性期刊1区)。在该研究中,他们设计出了在有ssRNA存在的情况下具有独特的协同活性,但在没有ssRNA的存在下没有活性的TLR8特异性小分子,是潜在的抗病毒试剂。

咪唑喹啉激动剂包括许多选择性TLR7激动剂和非选择性TLR7/8激动剂,但TLR8选择性激动剂很少。与R848相比,选择性TLR7激动剂R837可以通过加入一个羟基和一个乙氧基甲基链的修饰获得TLR8活性。研究团队通过对很少开发的2-氨基咪唑部分的构效关系研究来探索TLR8的选择性。他们对喹啉环的融合环系统进行拆分,得到四取代咪唑。合成四取代咪唑支架最大的挑战是位置1、2、4和5的区域选择性功能化。针对这个问题,研究团队选择将醇转化为叔丁基二甲基硅基(TBDMS)醚、TBDMS三氟酯和2,6-二甲基砒啶,利用正丁基锂在咪唑2位的酸性,添加DMF,得到2-甲酰基咪唑。接下来,研究团队进行了醛还原,合成Williamson醚,成功地在2号位添加了乙氧基甲基链;利用4位的亲核性,处理得到4-碘中间体;利用Suzuki偶联,去除四氢呋喃(THF)中四丁基氟化铵(TBAF)的保护基团,最终得到CU-CPD107。
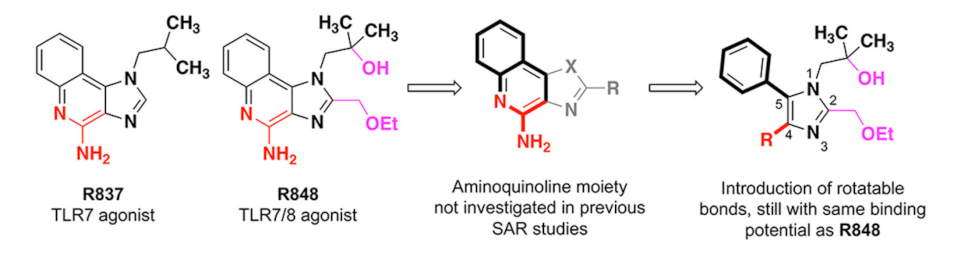
根据上述原理和合成路线,研究团队合成了一系列四取代咪唑衍生物,并在R848激活的HEK-Blue hTLR8或hTLR7细胞中使用SEAP检测活性。结果显示,CU-CPD107在HEK-Blue细胞可显著抑制R848诱导的信号传导,但对TLR7介导的信号传导没有影响。基于此,他们在咪唑的4位上寻找更多含有卤素的分子。开发靶向TLR的调节剂的一个挑战是设计特异性和效力。研究团队对CU-CPD107进行了一系列同源HTLR的测试,包括TLR1/TLR2, TLR2/TLR6, TLR3, TLR4, TLR5,TLR7和TLR9。结果显示,CU-CPD107仅抑制合成的小分子激动剂诱导的TLR8信号,而不影响其他TLR,在完整细胞中表现出高选择性。
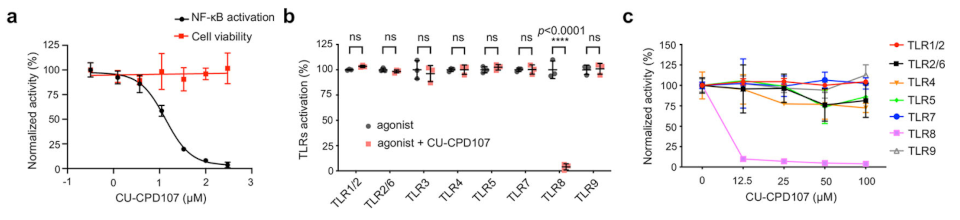
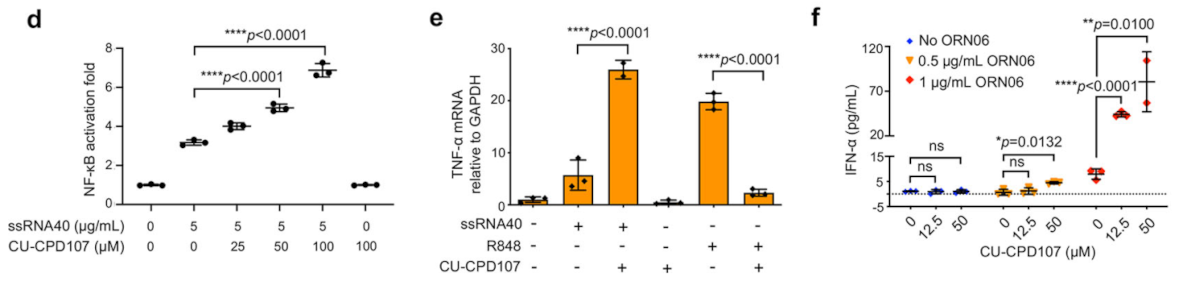
为了更好地模拟病毒感染,研究团队借助ORN06和ssRNA40(小鼠TLR7和人类TLR8的有效激动剂)测试CU-CPD107相应的ssRNA配体。他们观察到,在HEK-Blue hTLR8细胞中,CU-CPD107在ssRNA存在时表现为激动剂,在没有ssRNA的情况下则无活性。接下来,研究团队探究了CU-CPD107对HEK-Blue hTLR8细胞中几种下游细胞因子mRNA水平的影响。进一步证实了CU-CPD107的二分行为,并与SEAP分析的结果完全一致。进一步地,他们测定IFN-α和TNF-α以检测CU-CPD107在人PBMCs中ssRNA存在下的协同作用。结果显示,CU-CPD107与传统激动剂不同,仅在ssRNA的帮助下激活TLR8介导的信号,因此可避免引发不受控制的整体炎症反应。
基于以上结果,研究团队还尝试探索CU-CPD107的结构,以了解其结合模式和结构。他们设计了一系列类似物来扩展苯环。并对分离的人TLR8胞外域进行了一系列ITC实验以确定CU-CPD107的亲和力。结果显示,CUCPD107阻碍了R848与TLR8的结合。另外,CU-CPD107与TLR8结合,但不与ssRNA结合。这表明,CU-CPD107对与TLR8结合的R848和ssRNA配体有不同的影响。
为了进一步了解CU-CPD107的分子机制,研究团队制备了TLR8/CU-CPD107配合物的晶体。基于CU-CPD107与尿苷具有相同的行为,他们以人类TLR8/ssRNA40 (PDB: 4R08)的高分辨率x射线晶体结构为模型,将CU-CPD107与二级结合位点进行了连接。结果表明CU-CPD107与G351通过额外的氢键相互作用形成π-π键与F405叠加。对CU-CPD107结合位点内的残基进行额外的硅丙氨酸扫描,明确了CU-CPD107的二次位点比尿苷的结合更紧密。这种配体诱导的信号可能是一种有益的佐剂和抗病毒药物,因为免疫系统只有在ssRNA存在的情况下才会被激活。对残基进行实验突变,研究团队证实了G351A和F405A残基是与CU-CPD107结合所必需的。

总而言之,研究团队报道了一种选择性的双活性小分子CU-CPD107,它对小分子TLR8激动剂和ssRNA配体表现出不同的活性。在R848存在下,CU-CPD107作为TLR8信号通路抑制剂。该抑制剂不仅能对TLR8和TLR7进行选择,而且没有明显的毒性,可以作为细胞培养研究的化学工具。更重要的是,当ssRNA诱导激活TLR8信号通路时,CU-CPD107活性会逆转,并出现协同激动作用。在没有其他配体的情况下,CU-CPD107无活性,这解决了以往TLR7和TLR8激动剂作为疫苗佐剂或抗病毒药物存在的主要挑战。
值得一提的是,这种选择性激动剂对任何潜在的抗病毒治疗都是有利的,因为组织只有在受PAMPs感染时,如ssRNA病毒,才会引发炎症免疫反应,而健康的组织则不会受到影响,避免不必要的免疫反应。
MULTISCIENCE 联科生物 产品支撑

联科生物提供的ELISA试剂盒种类多样,质控严格,具有460+款试剂盒供您选择。更多信息请与我们联系4006721600。