大家知道巨噬细胞吗?作为固有免疫细胞,巨噬细胞可执行多种动态免疫功能,介导机体的防御与稳态、疾病的发生、组织的再生与重塑。在健康或病理条件下,具有良好可塑性的巨噬细胞可以极化为两种不同的表型,如经典激活的促炎表型(M1)或交替激活的抗炎表型(M2)。
近年来,人们发现巨噬细胞的促炎M1表型在癌症、病毒或细菌感染炎症的免疫治疗中具有重要协调作用。巨噬细胞M1极化可诱导促炎细胞因子(如肿瘤坏死因子α(TNF-α)、白细胞介素1β(IL-1β)、IL-6或IL-12等)等)的分泌,也可产生活性氧或活性氮(ROS和RNOS)。ROS或RNOS不仅能直接杀死病毒、微生物或肿瘤细胞,还能有效地逆转肿瘤。然而,小分子药物目前仍具有明显的系统毒性。因此,巨噬细胞免疫调节的临床应用仍然有限。

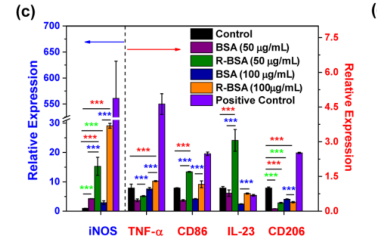
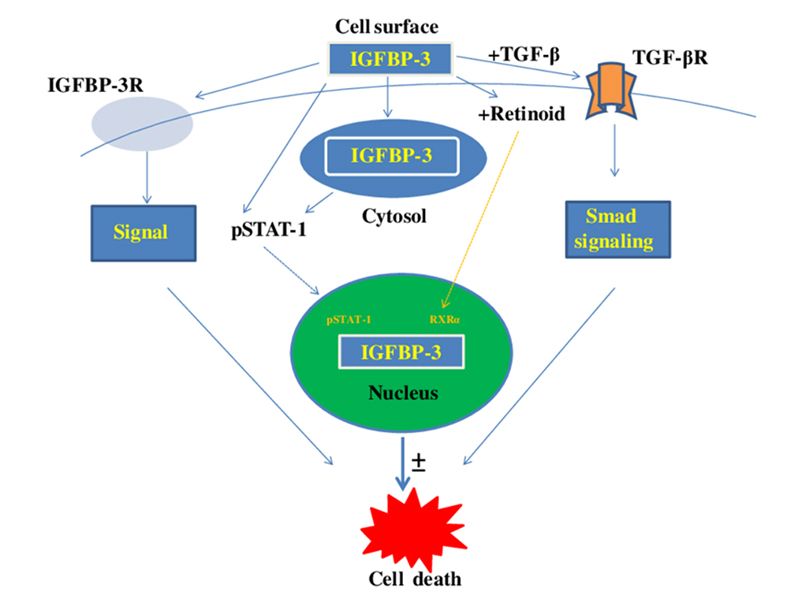
(a)R-BSA,(b) BSA@PSiNPs, R-BSA@PSiNPs纳米复合材料的合成路线和巨噬细胞与(c) BSA,(d) R-BSA,(e) BSA@PSiNPs和(f) R-BSA@PSiNPs相互作用以及相应的信号通路示意图
近日,来自南京林业大学理学院的研究团队在国际纳米领域顶级期刊《ACS Nano》发表了题为Porous silicon nanocarriers boost the immunomodulation of mitochondria-targeted bovine serum albumins on macrophage polarization的文章。该研究团队发现线粒体靶向牛血清白蛋白(BSAs)可以促进原始巨噬细胞向促炎M1表型极化,并伴有促炎介质的分泌,包括TNF-α、NO和ROS等。同时,线粒体靶向BSAs包覆层还可以改善多孔硅纳米内核对巨噬细胞的生物相容性。结合多孔硅纳米载体递送,进一步发现无论在体外或体内环境中均可以显著强化其免疫调控性能。
机制研究表明,多孔硅纳米载体可以有效地将线粒体靶向的BSAs递送到巨噬细胞中,进而通过干扰线粒体呼吸链以产生线粒体ROS,触发促炎转化的下游信号转导通路。实验结果表明,该多孔硅@BSA纳米系统具有良好的生物安全性、多种负载能力以及较强的促炎调节作用。因此,开发R-BSA@PSiNPs混合纳米系统,对癌症或病毒/细菌相关的感染性疾病的联合化疗免疫治疗方面具有重要的应用潜力。
联科生物助力科研
EK282/EK282HS——Mouse TNF-α ELISA kit