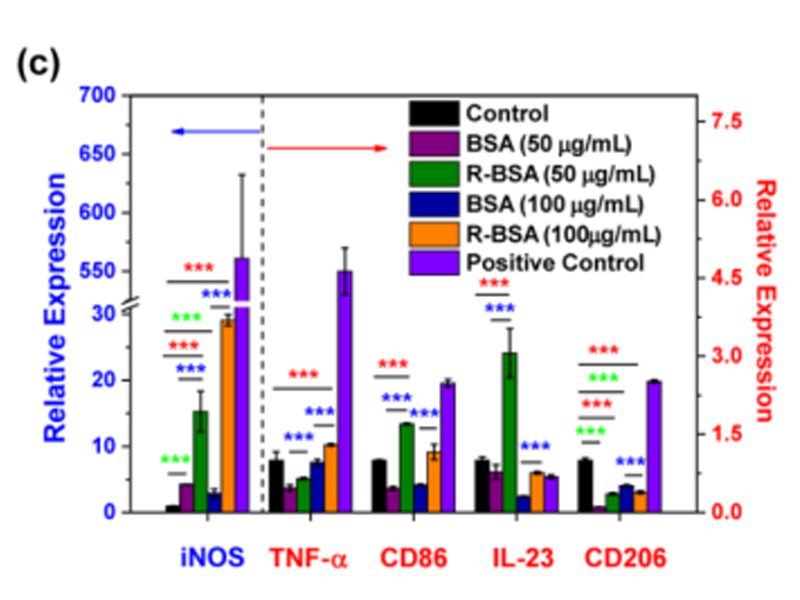
ELISA=Enzyme-Linked Immuno Sorbent Assay:酶联免疫吸附检测,其核心本质是利用抗原抗体的特异性反应,对样本中可溶性目的产物进行定量检测,是免疫学研究中一种常见的检测方法,也是蛋白定量的金标准。
根据目的产物的不同情况,常见的ELISA检测方法有双抗体夹心法、双抗原夹心法、竞争法和间接法。
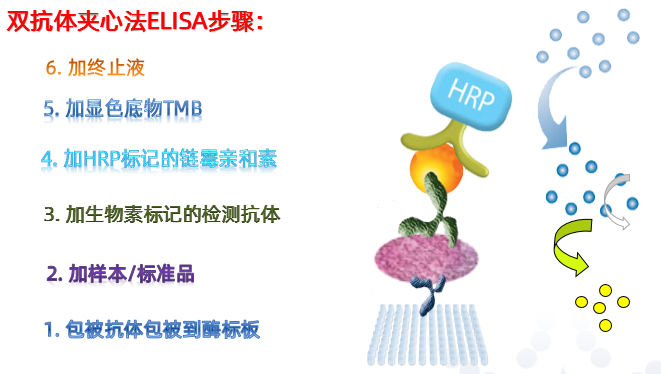
ELISA的操作步骤较为简单,可注意事项也不少。快来看看,这些你都注意到并做到了吗?
1. 试剂盒使用前室温平衡20-30分钟
温度是ELISA结合反应的重要影响因素,为使所有样本在一致的温度下反应,实验前务必将所有的试剂平衡至室温,包括检测样本,避免因温度的动力学反应差异而导致ELISA检测结果的不准确。若无该过程,可能导致一些弱阳性样本出现假阴性。
2. 规范加样:不规范的移液操作可能带来0.1%到5%的移液误差,甚至更高!
a. 移液器定期校准:选择密封性好质量可靠的吸头,吸量不准确,直接影响检测结果;
b. 加样前,溶液充分混匀,垂直悬空加入液体,避免加在孔壁上,不可产生气泡;
c. 加样时避免液体溅出,如有样本溅出,应用吸水纸轻轻拭干,并做相应记录;
d. 如果加样枪漏气以至于加样的量不够,不能用枪吸出再加,做相应记录实验;
e. 每次加样顺序一致,尤其底物、终止液顺序一致,保证每个孔显色时间相同。
3. 标准品的溶解与稀释,严格按说明书要求进行。
a. 粉末标准品短暂离心,让因运输沾到管盖、管壁的标准品沉到管底。
b. 根据瓶标签加入一定体积的蒸馏水(或说明书指定溶液),加水后轻柔涡旋震荡,室温静置溶解10-30分钟,让粉末完全溶解。
注意:加水(或说明书指定溶液)后暂不用移液枪吹吸,避免蛋白未溶解,枪头带出部分蛋白,待完全溶解后可吹吸或涡旋振荡混匀。
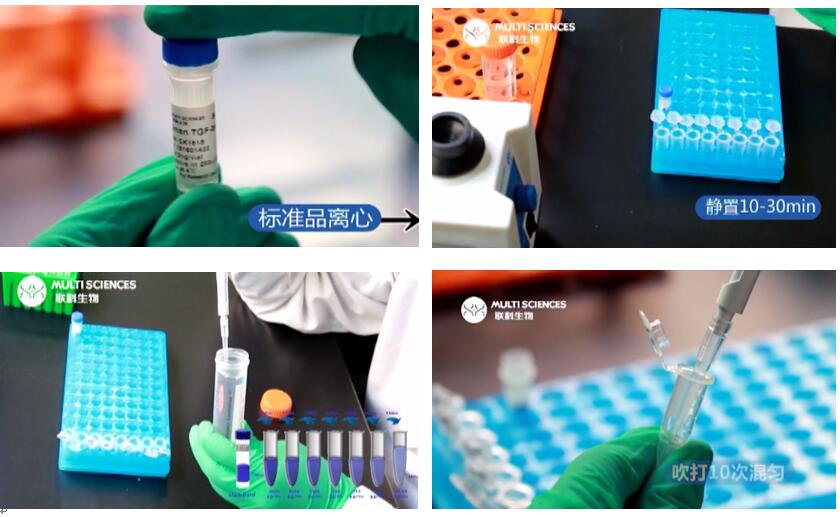
4. 标准品和样本做复孔
复孔的目的在于:可以计算检测结果平均值,使实验结果更准确;通过复孔结果对比,评估试剂盒的精密度及实验中是否存在误操作;
5. 震荡操作
a. 孵育过程震荡,可以加快、加强抗原抗体之间的相互碰撞接触,使得反应更加完全,OD值通常比未震荡孵育的结果要高;
b. 洗涤过程中震荡,可以使洗板更干净,很大程度上降低背景值,同时提高试剂盒检测的灵敏度。
6. 洗涤操作
a. 手工洗板,拍板时要垂直,避免交叉污染,用力不能过猛,防止抗原抗体复合物脱离;
b. 机器洗板应经常检查冲洗头是否畅通,若被杂物堵塞可用注射器针头挑出。
c. 扣干后的酶标板应立即加液,不能干板太久。

7. 显色判断
说明书中提供的显色时间仅为经验,具体时间需随时注意观察。通常最高浓度的标准品颜色不再变深,S1、S2、S3有明显梯度,S5有淡蓝色,或者标准品S1孔在630 nm的OD值在0.5-0.7、S5孔的OD值达到0.05-0.08,可以终止反应。

8. 检测
a. 酶标仪使用前务必预热10-15分钟,使结果更稳定;
b. 采用双波长测定吸光值,排除单波长检测时的测定干扰(样本的干扰、干扰色等)。一般采用最大波长为参考波长,在参考波长630 nm(570 nm)下,检测物的吸光值最小,检测波长450 nm和参考波长630 nm(570 nm)的吸光值之差可以消除非特异性吸收,双波长测定,可以最大限度的消除指纹、杂质及不透光的物质对酶标仪读数带来的误差,以保证实验数据的准确度。