CRISPR相关核酸酶蛋白9 (Cas9)的技术已经被开发和验证为治疗性基因组编辑的强大工具。然而,CRISPR-Cas9系统的高效交付仍然具有挑战性。基于CRISPR-Cas9的基因组编辑的主要障碍是传递效率低和缺乏组织特异性,这严重限制了其临床应用。为了进行治疗性基因组编辑,Cas9核酸酶和向导RNA (sgRNA)必须有效地传递到细胞中,并最终进入细胞核。 传递途径有三种选择,即编码Cas9和sgRNA的质粒DNA、Cas9 mRNA + sgRNA和Cas9核糖核蛋白(RNP; 与sgRNA复合物的蛋白质)。
RNP的传递避免了DNA和mRNA在转录和翻译过程中遇到的许多陷阱,允许在低免疫反应和弱脱靶活性的情况下快速启动编辑。到目前为止,体内RNP的研究主要集中在两类载体:聚合物基纳米颗粒和脂质体。 尽管这些非病毒载体可以保护RNP在血流中不降解,但在全身给药后,组织特异性基因组编辑仍然难以实现。
来自浙江大学药学院的研究团队在期刊Science Advances上发表了题Exosome-mediated delivery of Cas9 ribonucleoprotein complexes for tissue-specific gene therapy of liver diseases的学术论文, 他们开发的外泌体RNP为肝脏疾病的精确治疗和组织特异性基因治疗提供了一个新的策略。
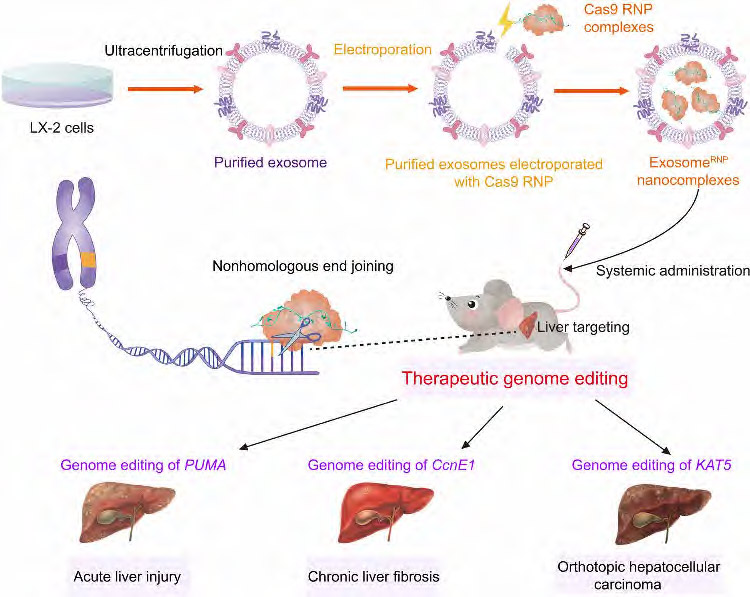
在这项研究中,研究团队开发了一种方法,使Cas9 RNP可以从肝星状细胞(HSCs; LX-2)用于治疗不同的肝脏疾病。与使用原代细胞相比,使用永生化细胞系在生产外泌体方面具有同质性、可重复性和可操作性等优点。通过优化的电穿孔方法,将Cas9 RNP加载到纯化的LX-2外泌体中,获得了被称为外泌体的基因组编辑传递系统。研究显示,外泌酶显示出强大的肝脏特异性基因组编辑活性和对肝损伤、肝纤维化和原位肝癌小鼠模型的有效治疗作用。 外泌体蛋白代表了Cas9 RNP高效传递的新一代内源性囊泡,并使肝脏疾病的精确治疗成为可能。
MULTISCIENCES 产品支撑:
- Mouse IL-6 ELISA Kit(EK206/3)
- Mouse IP-10 ELISA Kit(EK268/2)
- Mouse MCP-1 ELISA Kit (EK287/2)
- Mouse TNF-α ELISA Kit(EK282/2)



官网800x600-6.jpg)