基于金属有机框架(MOF)的治疗或诊断纳米材料已经很好地应用于癌症治疗。特别是,通过将光敏元件整合到MOF结构中,设计出具有良好光敏性和可调特性的MOF,并将其作为纳米光敏剂(nanoPSs)用于癌症的光动力治疗(PDT)。
PCN-224是一种典型的以Zr2+为金属离子,四(4-羧基苯基)卟啉(TCPP)为配体的nanoPSs。PDT可诱导免疫原性细胞死亡(ICD)。PDT倾向于利用先天免疫系统作为武器,在PDT治疗期间和之后能够实现长期的肿瘤杀伤反应。
但是,PDT反应强度弱、细胞质活性氧(ROS)诱导肿瘤细胞自噬等都会对治疗效果产生负面影响。一般来说,肿瘤细胞的自噬和线粒体自噬都被定义为肿瘤发展过程中的促肿瘤生存过程。因此,提高PDT治疗效果是目前面临的一个热点问题。
来自安徽中医药大学的研究团队在期刊《Biomaterials》上发表了题为Engineering mitochondrial uncoupler synergistic photodynamic nanoplatform to harness immunostimulatory pro-death autophagy/ mitophagy的研究论文,首次报道了CCCP负载和MnO2包被的多功能卟啉PCN-224纳米颗粒,通过利用自噬/自噬的促死亡作用和免疫调节作用来相互增强癌症PDT治疗效果。
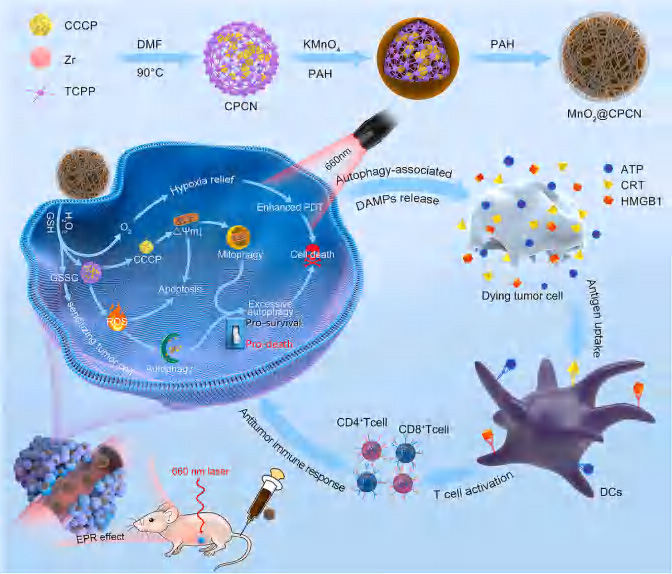
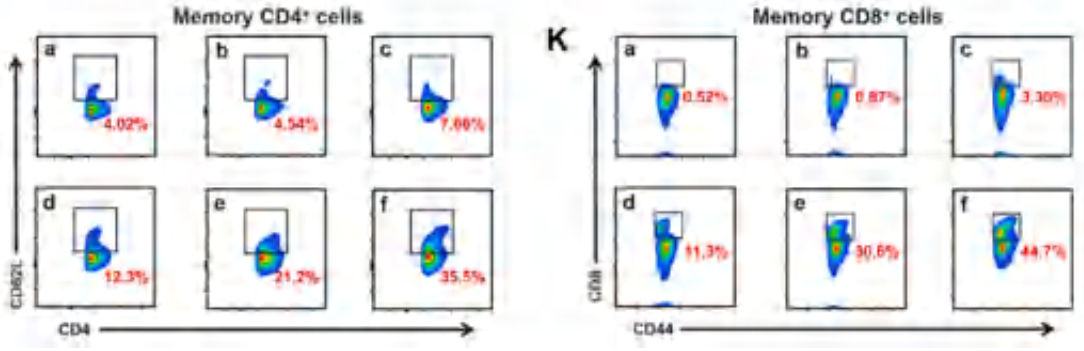
该团队构建了一个多功能纳米平台,可以人工增大癌细胞自噬/线粒体自噬的水平,最终将PDT过程中的“敌人”(促生存自噬)转化为“朋友”(促死亡自噬)。研究结果表明,沉积在PCN结构表面的MnO2包被壳层具有清除GSH和产氧活性的能力,可增强PDT效率。包被的CCCP作为一种典型的线粒体解偶联剂,可引起线粒体去极化和损伤,最终诱发适度的线粒体自噬。体外实验结果表明,在MnO2@CPCN介导的PDT作用下,癌细胞容易激活过度的细胞自噬/线粒体自噬,以清除受损的生物分子和线粒体,这会加剧肿瘤细胞的死亡。体内实验结果表明,MnO2@CPCN介导的PDT可引起过度的免疫刺激自噬和ICD,从而将治疗后的肿瘤转化为肿瘤相关抗原的原位仓库,引发强大和持久的抗肿瘤免疫反应。以该研究的结果来看,预计仿生和解偶联剂协同纳米平台可能为其他实体肿瘤的治疗提供更强大、更直接和更多功能的方法。
MULTISCIENCES产品支撑:
- Anti-Mouse CD3 FITC
- Anti-Mouse CD4 PE
- Anti-Mouse CD8 PerCP Cy5.5
- Anti-Mouse CD11c FITC
- Anti-Mouse CD44 FITC
- Anti-Mouse MHC-Ⅱ PE